Estados de agregación de la materia
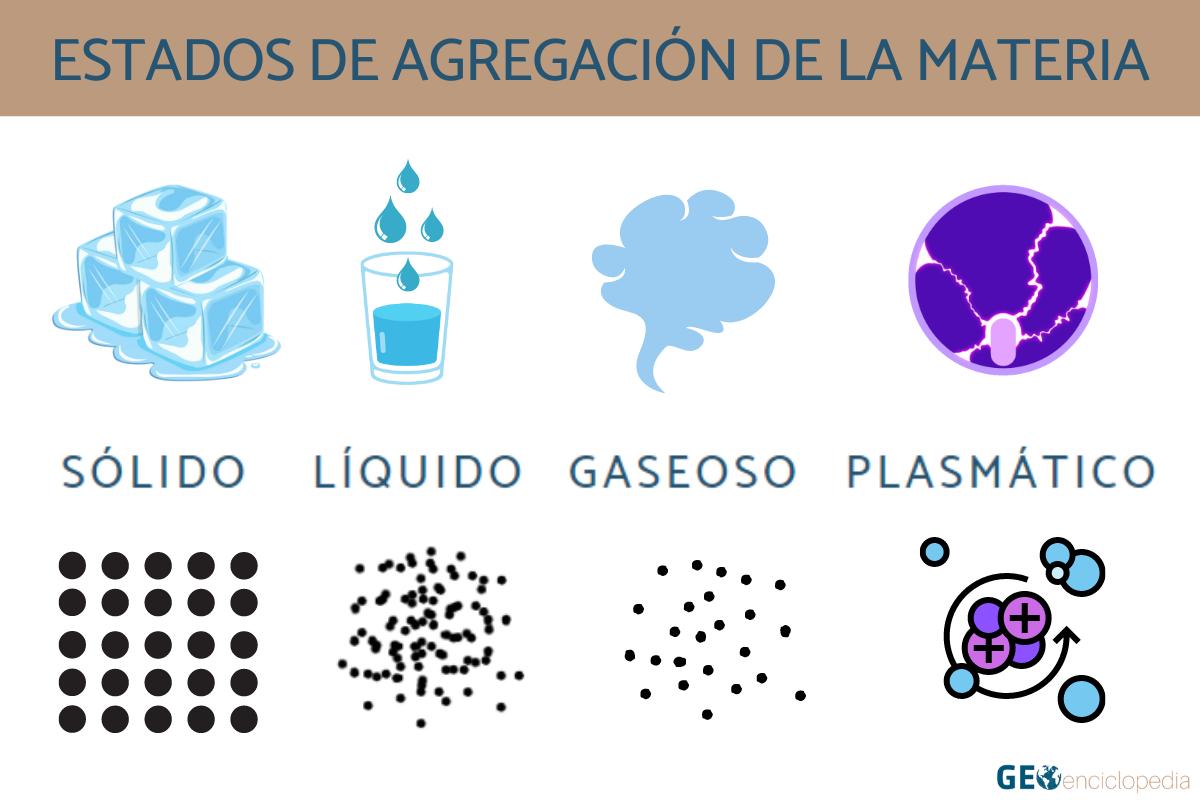
La materia se encuentra en la naturaleza en tres estados diferentes, dependiendo de las condiciones de presión y temperatura a las que se encuentre. Estos tres estados de la materia son sólido, líquido y gaseoso, y se definen por las propiedades físicas y estructurales de las partículas que componen la materia.
Estado sólido
En el estado sólido, las partículas que componen la materia se encuentran muy cerca unas de otras y están organizadas en una estructura ordenada. Esto hace que las partículas no tengan libertad de movimiento y se mantengan en una posición fija. El estado sólido se caracteriza por tener una forma y un volumen definidos, es decir, la materia mantiene su forma y no se expande para llenar un contenedor.
Los sólidos tienen una estructura molecular muy compacta y una fuerza de cohesión entre las partículas muy alta, lo que les confiere una gran resistencia a los cambios de forma y volumen. Algunos ejemplos de sustancias en estado sólido son el hierro, el vidrio o la sal.
Estado líquido
En el estado líquido, las partículas que componen la materia están más separadas que en el estado sólido, lo que les permite tener cierto grado de movimiento. A diferencia de los sólidos, los líquidos no tienen una estructura fija y adoptan la forma del recipiente que los contiene. Sin embargo, mantienen un volumen constante.
Los líquidos tienen una fuerza de cohesión menor que los sólidos, lo que les permite fluir y adaptarse a la forma de su contenedor. Esta fluidez les permite también ocupar el espacio disponible y mezclarse con otras sustancias. Algunos ejemplos de sustancias en estado líquido son el agua, el aceite o el alcohol.
Estado gaseoso
En el estado gaseoso, las partículas que componen la materia se encuentran muy separadas unas de otras y se mueven libremente en todas direcciones. Este movimiento constante hace que los gases no tengan forma ni volumen definidos, ya que tienden a expandirse y llenar completamente el recipiente que los contiene.
Los gases tienen una fuerza de cohesión muy baja, lo que les permite ocupar grandes volúmenes y expandirse sin límites. También tienen la capacidad de mezclarse fácilmente con otras sustancias y difundirse por todo el espacio disponible. Algunos ejemplos de sustancias en estado gaseoso son el oxígeno, el dióxido de carbono o el vapor de agua.
Cambios de estado de la materia
Los estados de la materia pueden cambiar de uno a otro mediante la aplicación de calor o frío, lo que provoca cambios en la estructura y en las propiedades de las partículas que componen la materia. Estos cambios de estado se conocen como fusion, solidificación, vaporización, condensación, sublimación y deposición.
Fusión
La fusión es el proceso en el cual una sustancia en estado sólido pasa al estado líquido al aumentar su temperatura por encima de su punto de fusión. Durante la fusión, las partículas de la sustancia adquieren suficiente energía cinética para romper las fuerzas de cohesión que las mantenían en una estructura sólida ordenada.
Solidificación
La solidificación es el proceso inverso a la fusión, en el cual una sustancia en estado líquido pasa al estado sólido al disminuir su temperatura por debajo de su punto de solidificación. Durante la solidificación, las partículas de la sustancia pierden energía cinética y se organizan en una estructura sólida, formando enlaces y adoptando una disposición ordenada.
Vaporización
La vaporización es el proceso en el cual una sustancia en estado líquido pasa al estado gaseoso al aumentar su temperatura por encima de su punto de ebullición. Durante la vaporización, las partículas de la sustancia adquieren suficiente energía para romper las fuerzas de cohesión y escapar del líquido en forma de vapor.
Condensación
La condensación es el proceso inverso a la vaporización, en el cual una sustancia en estado gaseoso pasa al estado líquido al perder calor y disminuir su energía cinética. Durante la condensación, las partículas de la sustancia se acercan unas a otras y se organizan en una estructura líquida, formando enlaces y adoptando una disposición ordenada.
Sublimación
La sublimación es el proceso en el cual una sustancia en estado sólido pasa directamente al estado gaseoso sin pasar por el estado líquido. Durante la sublimación, las partículas de la sustancia adquieren suficiente energía para romper las fuerzas de cohesión y escapar del sólido en forma de vapor, sin fundirse previamente.
Deposición
La deposición es el proceso inverso a la sublimación, en el cual una sustancia en estado gaseoso pasa directamente al estado sólido sin pasar por el estado líquido. Durante la deposición, las partículas de la sustancia pierden calor y disminuyen su energía cinética, organizándose en una estructura sólida, formando enlaces y adoptando una disposición ordenada.