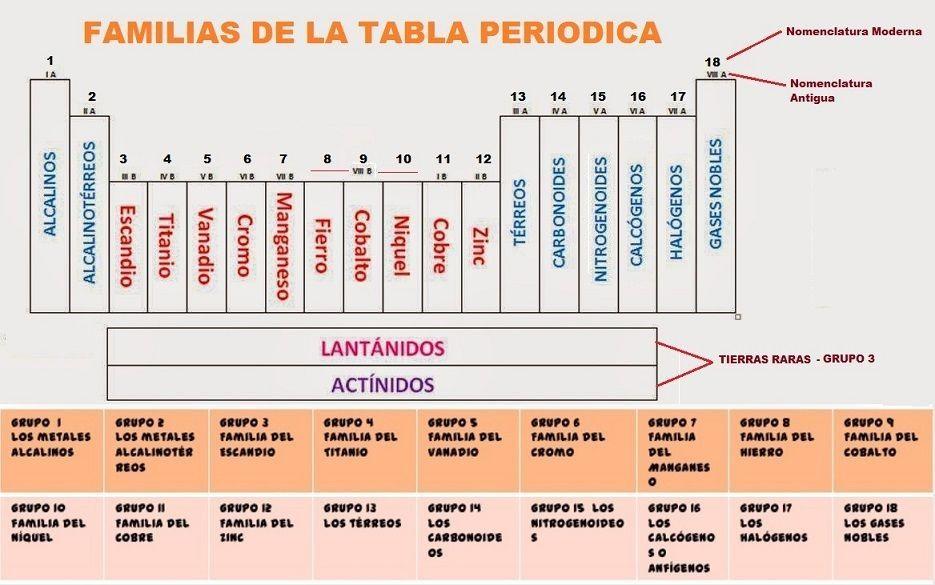
La tabla periódica de los elementos es una herramienta fundamental en el estudio de la química, ya que organiza todos los elementos químicos conocidos de acuerdo a sus propiedades y comportamiento en los compuestos. Una de las formas en que la tabla periódica organiza los elementos es a través de los grupos, también conocidos como familias, que son columnas verticales que comparten características químicas similares. En este artículo, exploraremos las características de los grupos de la tabla periódica, así como sus aplicaciones y ejemplos relevantes.
Grupo 1: Los metales alcalinos
El grupo 1 de la tabla periódica está formado por los metales alcalinos, incluyendo elementos como el litio, el sodio y el potasio. Estos elementos son altamente reactivos y tienden a perder un electrón para formar iones positivos, lo que los hace buenos conductores de electricidad y calor. Además, los metales alcalinos son suaves y tienen bajos puntos de fusión, lo que los hace útiles en aplicaciones como baterías, aleaciones metálicas y reacciones químicas.
Propiedades químicas
Los metales alcalinos reaccionan violentamente con el agua, formando hidróxidos alcalinos y desprendiendo gas hidrógeno. Esta reactividad los hace útiles como agentes reductores en la síntesis de compuestos orgánicos.
Aplicaciones
El sodio y el potasio son utilizados en la fabricación de medicamentos y en la industria alimentaria para la conservación de alimentos. Además, el litio se utiliza en la fabricación de baterías recargables, en aleaciones metálicas y en la industria nuclear.
Grupo 17: Los halógenos
El grupo 17 de la tabla periódica está formado por los halógenos, incluyendo elementos como el flúor, el cloro y el yodo. Estos elementos son altamente reactivos y tienden a ganar un electrón para formar iones negativos, lo que los hace buenos oxidantes. Los halógenos son u grupos de no-metales muy reactivos y se encuentran en estado gaseoso, líquido o sólido en condiciones normales en la naturaleza.
Propiedades químicas
Los halógenos reaccionan fácilmente con metales para formar sales, y también pueden reaccionar con hidrógeno para formar ácidos. Esta reactividad los hace útiles en la fabricación de compuestos orgánicos, la desinfección del agua y la conservación de alimentos.
Aplicaciones
El flúor se utiliza en la elaboración de productos dentales para prevenir la caries, mientras que el cloro se utiliza en el tratamiento del agua potable para eliminar microorganismos y compuestos orgánicos. El yodo se utiliza en la fabricación de tintes y en aplicaciones medicinales, como en el tratamiento de trastornos de la glándula tiroides.
Grupo 18: Los gases nobles
El grupo 18 de la tabla periódica está formado por los gases nobles, incluyendo elementos como el helio, el neón y el argón. Estos elementos son extremadamente estables y no tienden a formar compuestos químicos con otros elementos, lo que los hace únicos en la tabla periódica. Además, los gases nobles tienen propiedades de conducción eléctrica que los hacen útiles en la fabricación de dispositivos electrónicos.
Propiedades químicas
Los gases nobles son químicamente inertes, lo que significa que tienden a no reaccionar con otros elementos. Esto se debe a que tienen un completo nivel de energía externa, lo que les otorga una alta estabilidad.
Aplicaciones
El helio se utiliza en la refrigeración de máquinas y en la fabricación de globos aerostáticos, el neón se utiliza en la fabricación de lámparas de neón y el argón se utiliza en la fabricación de lámparas de luz de arco.
Grupo 13: Los metales del grupo del boro
El grupo 13 de la tabla periódica está formado por los metales del grupo del boro, incluyendo elementos como el aluminio, el galio y el indio. Estos elementos tienen propiedades metálicas, pero también comparten algunas características con los no metales, como la formación de compuestos covalentes.
Propiedades químicas
Los metales del grupo del boro tienen una alta resistencia y son buenos conductores de electricidad. Además, pueden formar compuestos con alto punto de fusión, lo que los hace útiles en aplicaciones de alta temperatura.
Aplicaciones
El aluminio se utiliza ampliamente en la fabricación de envases, cables eléctricos y componentes de aeronaves, mientras que el galio se utiliza en aplicaciones electrónicas y el indio se utiliza en la fabricación de pantallas de cristal líquido.
Grupo 2: Los metales alcalinotérreos
El grupo 2 de la tabla periódica está formado por los metales alcalinotérreos, incluyendo elementos como el calcio, el magnesio y el berilio. Estos elementos son menos reactivos que los metales alcalinos del grupo 1, pero aún así son capaces de perder electrones para formar iones positivos.
Propiedades químicas
Los metales alcalinotérreos tienden a formar compuestos iónicos con no metales, y sus compuestos son importantes en la industria y en aplicaciones biológicas.
Aplicaciones
El calcio se utiliza en la fabricación de productos lácteos, suplementos dietéticos y en la construcción de huesos y dientes, mientras que el magnesio se utiliza en aleaciones metálicas y en la industria aeroespacial. El berilio se utiliza en la fabricación de aleaciones ligeras y en aplicaciones nucleares.
Grupo 3-12: Los metales de transición
Los elementos de los grupos 3-12 son conocidos como metales de transición, ya que se encuentran en la región central de la tabla periódica y tienen propiedades intermedias entre los metales alcalinos y los no metales. Estos elementos tienen una alta conductividad eléctrica y térmica, y suelen formar compuestos de colores vivos y con diversas propiedades.
Propiedades químicas
Los metales de transición tienen una amplia variedad de estados de oxidación y pueden formar compuestos con distintas geometrías moleculares. Estas características les otorgan una gran versatilidad en aplicaciones químicas y biológicas.
Aplicaciones
Los metales de transición se utilizan en la fabricación de productos electrónicos, catalizadores industriales, joyería y en aplicaciones médicas, como en la fabricación de prótesis y dispositivos de imagen médica.
Grupo 16: Los calcógenos
El grupo 16 de la tabla periódica está formado por los calcógenos, incluyendo elementos como el oxígeno, el azufre y el selenio. Estos elementos son no metales reactivos que tienden a ganar electrones para formar compuestos iónicos con metales.
Propiedades químicas
Los calcógenos forman compuestos con propiedades ácidas, como el ácido sulfúrico y el ácido selenioso. Además, pueden formar compuestos covalentes con otros no metales, como el dióxido de carbono y el agua.
Aplicaciones
El oxígeno se utiliza en la respiración celular y en aplicaciones médicas, como en la oxigenoterapia. El azufre se utiliza en la fabricación de fertilizantes y en la industria del caucho, y el selenio se utiliza en la fabricación de vidrio y en aplicaciones fotovoltaicas.
Grupo 14: Los carbonoideos
El grupo 14 de la tabla periódica está formado por los carbonoideos, incluyendo elementos como el carbono, el silicio y el estaño. Estos elementos tienen propiedades tanto metálicas como no metálicas, y son fundamentales en la química orgánica e inorgánica.
Propiedades químicas
El carbono es el único elemento que puede formar enlaces covalentes con otros átomos de carbono, lo que le otorga una gran diversidad de compuestos, como los hidrocarburos, los alcoholes y los ácidos carboxílicos. El silicio se utiliza en la fabricación de semiconductores y en aplicaciones electrónicas, mientras que el estaño se utiliza en la fabricación de envases y en la industria de la soldadura.
Aplicaciones
El carbono se utiliza en la fabricación de materiales compuestos, como el grafeno y los nanotubos de carbono, y en la industria de los polímeros. El silicio se utiliza en la fabricación de chips de computadora y en la producción de energía solar, mientras que el estaño se utiliza en la fabricación de soldaduras y en la producción de aleaciones.
Grupo 15: Los pnictógenos
El grupo 15 de la tabla periódica está formado por los pnictógenos, incluyendo elementos como el nitrógeno, el fósforo y el bismuto. Estos elementos tienen propiedades no metálicas y son fundamentales en la química orgánica e inorgánica.
Propiedades químicas
El nitrógeno es un gas inerte que constituye la mayor parte del aire atmosférico, mientras que el fósforo es un no metal que puede formar compuestos iónicos y covalentes. Por otro lado, el bismuto es un metal pesado que se utiliza en la fabricación de aleaciones y en aplicaciones medicinales.
Aplicaciones
El nitrógeno se utiliza en la fabricación de fertilizantes y en la industria alimentaria, el fósforo se utiliza en la producción de insecticidas y fertilizantes, y el bismuto se utiliza en la fabricación de soldaduras y en aplicaciones médicas, como en la fabricación de medicamentos para el tratamiento de úlceras y trastornos del sistema gastrointestinal.
Grupo de los lantánidos y actínidos
Los grupos de los lantánidos y actínidos se encuentran en la región central de la tabla periódica, y están formados por elementos conocidos como tierras raras y actínidos, respectivamente. Estos elementos tienen propiedades metálicas y son fundamentales en la fabricación de dispositivos electrónicos y en aplicaciones nucleares.
Propiedades químicas
Los lantánidos tienen una alta reactividad química y pueden formar compuestos con diversas aplicaciones, como en la fabricación de imanes permanentes y catalizadores. Por otro lado, los actínidos son elementos radioactivos que se utilizan en aplicaciones nucleares, como en la generación de energía y en la fabricación de material fisionable.
Aplicaciones
Los lantánidos se utilizan en la fabricación de dispositivos electrónicos, como pantallas de televisores y lámparas fluorescentes, y en la fabricación de catalizadores para reacciones químicas. Por otro lado, los actínidos se utilizan en la fabricación de reactores nucleares y en la fabricación de materiales para aplicaciones médicas, como en la radioterapia y en la exploración de isótopos para diagnósticos médicos.
En conclusión, la tabla periódica organiza los elementos químicos de acuerdo a sus propiedades y comportamiento en los compuestos, lo que permite a los científicos y químicos comprender y predecir el comportamiento de los elementos. Los grupos de la tabla periódica comparten características químicas similares y tienen aplicaciones fundamentales en la industria, la medicina, la tecnología y la investigación científica. El estudio de los grupos de la tabla periódica es esencial en el avance de la química y en la exploración de nuevas aplicaciones y tecnologías.