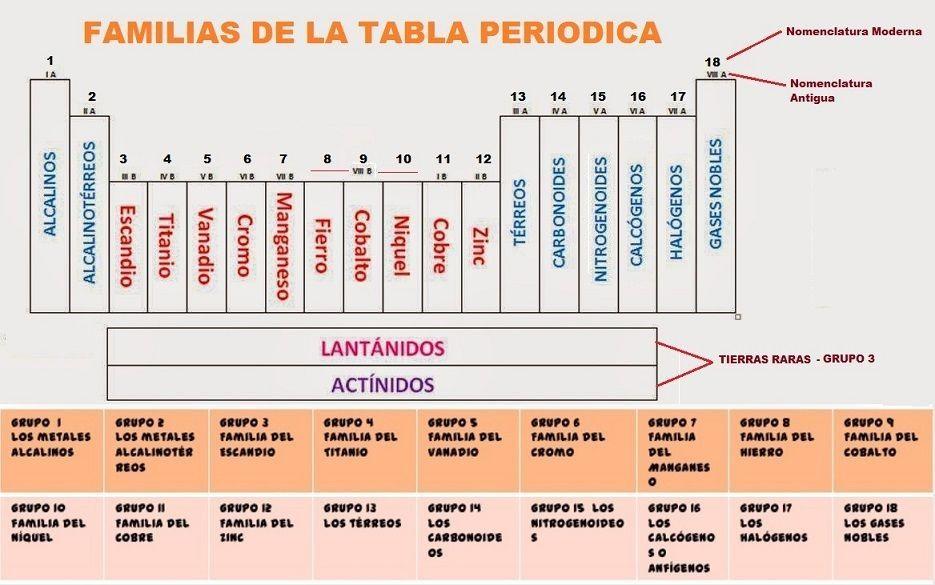
Las características de los grupos de la tabla periódica
La tabla periódica es una herramienta fundamental en la química, ya que organiza todos los elementos conocidos en función de sus propiedades. Los elementos se organizan en filas y columnas de acuerdo con su número atómico, configuración electrónica y propiedades químicas, lo que facilita la comprensión de sus características y comportamientos. En este artículo, exploraremos las características de los grupos de la tabla periódica y su importancia en la química moderna.
Los grupos de la tabla periódica, también conocidos como familias, son columnas verticales que comparten características químicas y propiedades físicas similares. Cada grupo está compuesto por elementos con el mismo número de electrones en su capa de valencia, lo que determina su reactividad y comportamiento. A continuación, analizaremos las características de algunos grupos específicos y su importancia en la química.
Grupo 1: Metales alcalinos
El grupo 1 de la tabla periódica está compuesto por los metales alcalinos, que incluyen el litio, el sodio, el potasio, el rubidio, el cesio y el francio. Estos elementos son altamente reactivos y se oxidan rápidamente en presencia de oxígeno. Tienen un solo electrón en su capa de valencia, lo que los hace altamente propensos a perderlo en reacciones químicas. Los metales alcalinos son blandos, tienen bajos puntos de fusión y ebullición, y son excelentes conductores de electricidad.
Estos elementos son ampliamente utilizados en la industria para la fabricación de productos químicos, baterías y aleaciones metálicas. El hidróxido de sodio, por ejemplo, es un producto químico ampliamente utilizado en la fabricación de papel, textiles y productos de limpieza. Además, los metales alcalinos tienen aplicaciones en la medicina, la agricultura y la tecnología.
Grupo 18: Gases nobles
Los gases nobles, también conocidos como gases inertes, conforman el grupo 18 de la tabla periódica e incluyen el helio, el neón, el argón, el criptón, el xenón y el radón. Estos elementos tienen una configuración electrónica muy estable, lo que los hace químicamente inactivos. Debido a su baja reactividad, los gases nobles son utilizados en aplicaciones donde se requiere un ambiente inerte, como la soldadura, la iluminación y la conservación de materiales sensibles a la oxidación.
El helio, por ejemplo, se utiliza en aplicaciones de refrigeración criogénica y en la industria aeroespacial. El neón es ampliamente conocido por su uso en letreros luminosos, debido a su característico brillo rojizo. Además, el argón se utiliza en la fabricación de lámparas incandescentes y en la industria metalúrgica debido a su capacidad para crear un ambiente inerte.
Grupo 17: Halógenos
Los halógenos conforman el grupo 17 de la tabla periódica e incluyen el flúor, el cloro, el bromo, el yodo y el astato. Estos elementos son altamente reactivos y tienen una alta afinidad por los electrones, lo que los convierte en poderosos agentes oxidantes. Los halógenos son utilizados en la fabricación de productos químicos, medicamentos y plaguicidas, así como en la purificación del agua y la desinfección.
El flúor, por ejemplo, se utiliza en la producción de numerosos compuestos químicos, incluyendo el ácido fluorhídrico y el fluoruro de sodio. El cloro es ampliamente utilizado en la desinfección del agua, la fabricación de PVC y la industria química. Además, el yodo se utiliza en la medicina, la fotografía y la fabricación de tintes y colorantes.
Grupo 3-12: Metales de transición
Los metales de transición conforman los grupos 3 a 12 de la tabla periódica e incluyen elementos como el hierro, el cobre, el zinc, el níquel y el oro. Estos elementos son conocidos por su alta conductividad eléctrica, resistencia mecánica y versatilidad en aplicaciones industriales y tecnológicas. Los metales de transición son ampliamente utilizados en la fabricación de aleaciones, herramientas, equipos electrónicos y joyería.
El hierro, por ejemplo, es el metal más ampliamente utilizado en la construcción, la fabricación de vehículos y la producción de acero. El cobre es valorado por su alta conductividad eléctrica y se utiliza en la fabricación de cables, bobinas y componentes electrónicos. Además, el oro es apreciado por su belleza, durabilidad y resistencia a la corrosión, lo que lo hace altamente deseable en la industria de la joyería y la electrónica.
Grupo 13: Metales del grupo del aluminio
El grupo 13 de la tabla periódica está compuesto por los metales del grupo del aluminio, que incluyen el aluminio, el galio, el indio y el talio. Estos elementos tienen tres electrones en su capa de valencia y son utilizados en una amplia gama de aplicaciones industriales y tecnológicas. El aluminio, en particular, es el metal no ferroso más ampliamente utilizado en el mundo, debido a su bajo peso, resistencia a la corrosión y facilidad de fabricación.
El aluminio se utiliza en la fabricación de aviones, automóviles, envases de alimentos, cables eléctricos y componentes electrónicos. El galio tiene propiedades semiconductores y se utiliza en la fabricación de diodos emisores de luz (LED) y dispositivos fotovoltaicos. Además, el indio se utiliza en la fabricación de pantallas táctiles, materiales superconductores y paneles solares.
Importancia de entender las características de los grupos de la tabla periódica
Comprender las características de los grupos de la tabla periódica es fundamental para la química moderna, ya que permite predecir el comportamiento y las propiedades de los elementos en diferentes contextos. Esta comprensión es crucial en la investigación, el diseño de nuevos materiales y compuestos, y la optimización de procesos industriales y tecnológicos.
La organización de los elementos en grupos basados en sus propiedades químicas y físicas facilita la identificación de patrones y tendencias en la tabla periódica. Por ejemplo, se puede observar que los elementos de un mismo grupo comparten valencias similares y tienden a formar compuestos con propiedades químicas comunes. Esta información es invaluable para el diseño de materiales específicos, la optimización de reacciones químicas y la aplicación de compuestos en diversas industrias.
Además, comprender las características de los grupos de la tabla periódica permite identificar aplicaciones específicas para cada elemento, lo que es fundamental en campos como la medicina, la ingeniería, la energía y la tecnología. Por ejemplo, los metales de transición son ampliamente utilizados en la fabricación de dispositivos electrónicos debido a su conductividad eléctrica, resistencia mecánica y durabilidad. Por otro lado, los gases nobles son utilizados en aplicaciones donde se requiere un ambiente inerte, como la soldadura y la iluminación.
En conclusión, las características de los grupos de la tabla periódica son fundamentales para comprender el comportamiento y las propiedades de los elementos, así como para identificar aplicaciones específicas en la industria, la tecnología y la investigación. El conocimiento de la tabla periódica y sus grupos es esencial para avanzar en la química y la ciencia de materiales, y es fundamental para el desarrollo de nuevas tecnologías y aplicaciones innovadoras. Es importante seguir estudiando y explorando las propiedades de los elementos para aprovechar al máximo su potencial en diferentes campos.